Berikut yang Benar Tentang Laju Reaksi
Laju reaksi , itu topik yang seru banget kan? Bayangin aja , proses kimia yang terjadi di sekitar kita , setiap detiknya ada reaksi kimia yang berlangsung dengan kecepatan yang berbeda-beda!. Ada yang cepet banget , kayak ledakan petasan , tapi ada juga yang lambat banget , misalnya karat besi yang makan waktu berbulan-bulan bahkan bertahun-tahun !. Nah , untuk memahami semua ini , kita perlu ngerti tentang laju reaksi. Apa sih sebenarnya laju reaksi itu ? Gimana cara menghitungnya ? Faktor apa aja yang mempengaruhinya ? . Pertanyaan-pertanyaan inilah yang bakalan kita bahas tuntas di artikel ini , supaya kamu bener-bener ngerti tentang seluk-beluk laju reaksi !.
Perlu kamu ketahui , laju reaksi itu sebenarnya menunjukkan seberapa cepat suatu reaksi kimia berlangsung . Kita bisa mengukurnya dengan melihat seberapa cepat konsentrasi reaktan berkurang , atau seberapa cepat konsentrasi produk bertambah dalam suatu periode waktu tertentu!. Contohnya , misalnya reaksi antara asam klorida & magnesium. Reaksi ini akan menghasilkan gas hidrogen & garam magnesium . Semakin cepat gas hidrogen terbentuk , maka semakin cepat pula laju reaksinya. Mudah kan ? . Nggak perlu pusing-pusing !.
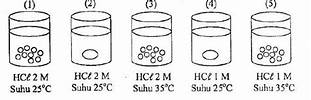
Sekarang , kita bahas lebih detail yuk tentang faktor-faktor yang memengaruhi laju reaksi ini!. Ada banyak faktor , mulai dari konsentrasi reaktan , luas permukaan , suhu , katalis , & tekanan (untuk reaksi yang melibatkan gas) !. Konsentrasi reaktan , semakin tinggi konsentrasi reaktan , maka peluang tumbukan antar partikel reaktan akan semakin besar , sehingga laju reaksi juga akan semakin cepat. Mudah dibayangkan ya, kayak lagi main bola , semakin banyak pemain , semakin banyak juga peluang untuk mencetak gol!. Sama halnya dengan luas permukaan , semakin luas permukaan reaktan , semakin banyak pula tempat terjadinya reaksi , jadi laju reaksi semakin cepat!. Bayangkan , mengolah gula pasir & gula batu , gula pasir lebih cepat larut karena luas permukaannya lebih besar!.
Nah , faktor selanjutnya adalah suhu !. Semakin tinggi suhu , semakin besar energi kinetik partikel reaktan , sehingga peluang tumbukan efektif & laju reaksi meningkat!. Ini mirip kayak kamu berlari , semakin cepat lari , semakin cepat sampai ke tujuan , kan ?. Lalu ada juga katalis , katalis adalah zat yang dapat mempercepat laju reaksi tanpa ikut bereaksi , jadi ia hanya sebagai perantara!. Hebat , kan ?. Terakhir ada tekanan (khusus untuk reaksi gas) , semakin tinggi tekanan , semakin tinggi pula konsentrasi gas , maka semakin cepat laju reaksi!. Paham semua sampai sini ?.
Mengenal Lebih Dekat Laju Reaksi: Seberapa Cepat Reaksi Kimia Terjadi?
Pernahkah kamu memperhatikan bagaimana sepotong besi berkarat secara perlahan, sementara makanan di lemari es membusuk lebih cepat saat cuaca panas? Itu semua berkaitan dengan laju reaksi. Memahami laju reaksi, atau kecepatan reaksi kimia, sangat penting, baik dalam kehidupan sehari-hari maupun di berbagai industri. Artikel ini akan membantumu memahami konsep penting ini secara lebih mendalam.
Apa itu Laju Reaksi? Definisi dan Pengertiannya
Laju reaksi adalah ukuran seberapa cepat reaksi kimia berlangsung. Ia menyatakan perubahan konsentrasi reaktan atau produk per satuan waktu. Semakin besar laju reaksi, semakin cepat reaksi kimia tersebut terjadi. Konsep ini mendasari pemahaman banyak proses kimia, baik yang sederhana maupun kompleks.
Definisi Sederhana Laju Reaksi
Bayangkan kamu sedang memasak. Jika makananmu matang dengan cepat, berarti laju reaksi masakanmu tinggi. Sebaliknya, jika makananmu lama matang, maka laju reaksi masakanmu rendah. Begitulah sederhana penjelasan laju reaksi. Ia mengukur seberapa cepat reaktan berubah menjadi produk.
Perbedaan Laju Reaksi dan Kecepatan Reaksi (jika ada perbedaan yang signifikan)
Istilah "laju reaksi" dan "kecepatan reaksi" seringkali digunakan secara bergantian, dan memang tidak ada perbedaan signifikan di antara keduanya. Keduanya merujuk pada seberapa cepat suatu reaksi kimia berlangsung.
Contoh Laju Reaksi dalam Kehidupan Sehari-hari
Banyak contoh laju reaksi dalam kehidupan sehari-hari. Pembusukan buah yang lebih cepat di suhu ruang dibandingkan di dalam kulkas, karat pada besi yang terbentuk secara bertahap, dan pembakaran kayu yang menghasilkan api dengan cepat adalah beberapa contohnya. Bahkan proses pencernaan makanan di dalam tubuh kita juga dipengaruhi oleh laju reaksi enzimatis.
Faktor-Faktor yang Mempengaruhi Laju Reaksi Kimia
Beberapa faktor penting dapat mempengaruhi seberapa cepat suatu reaksi kimia berlangsung. Pemahaman faktor-faktor ini krusial untuk mengontrol dan memanipulasi kecepatan reaksi.
Konsentrasi Reakstan: Semakin Konsentrasi, Semakin Cepat?
Semakin tinggi konsentrasi reaktan, semakin sering partikel-partikel reaktan bertumbukan, sehingga meningkatkan peluang terjadinya reaksi dan meningkatkan laju reaksi. Bayangkan kamu mencampur gula ke dalam air panas – semakin banyak gula, semakin cepat larut (reaksi pelarutan).
Luas Permukaan Kontak: Mengapa Serbuk Lebih Cepat Bereaksi?
Reaksi kimia terjadi pada permukaan zat. Jika luas permukaan kontak antara reaktan lebih besar, maka lebih banyak partikel yang dapat bereaksi secara bersamaan, sehingga laju reaksi meningkat. Serbuk besi akan berkarat lebih cepat daripada besi batangan karena luas permukaannya yang jauh lebih besar.
Suhu: Bagaimana Panas Mempengaruhi Kecepatan Reaksi?
Meningkatkan suhu meningkatkan energi kinetik partikel-partikel reaktan. Partikel-partikel yang bergerak lebih cepat akan lebih sering dan lebih kuat bertumbukan, sehingga meningkatkan laju reaksi. Itulah mengapa makanan lebih cepat matang pada suhu yang lebih tinggi.
Katalis: Ajaibnya Zat yang Mempercepat Reaksi Kimia!
Katalis adalah zat yang mempercepat laju reaksi tanpa ikut bereaksi sendiri. Ia bekerja dengan menurunkan energi aktivasi, yaitu energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Enzim dalam tubuh kita adalah contoh katalis biologis.
Tekanan (khusus untuk reaksi gas): Bagaimana Tekanan Mempengaruhi Laju Reaksi?
Pada reaksi yang melibatkan gas, peningkatan tekanan akan meningkatkan konsentrasi partikel-partikel gas per satuan volume. Hal ini menyebabkan lebih banyak tumbukan dan meningkatkan laju reaksi.
Mengukur Laju Reaksi: Metode dan Cara Pengukuran
Pengukuran laju reaksi dapat dilakukan dengan berbagai metode, tergantung pada jenis reaksi yang diamati.
Metode Pengukuran Berdasarkan Perubahan Konsentrasi
Metode ini melibatkan pengukuran perubahan konsentrasi reaktan atau produk selama periode waktu tertentu. Teknik spektrofotometri sering digunakan untuk mengukur perubahan konsentrasi.
Metode Pengukuran Berdasarkan Perubahan Volume Gas
Jika reaksi menghasilkan atau mengonsumsi gas, laju reaksi dapat diukur dengan mengukur perubahan volume gas yang dihasilkan atau dikonsumsi per satuan waktu.
Metode Pengukuran Berdasarkan Perubahan Massa
Metode ini cocok untuk reaksi yang melibatkan perubahan massa, misalnya reaksi yang menghasilkan endapan. Laju reaksi diukur berdasarkan perubahan massa per satuan waktu.
Contoh Perhitungan Laju Reaksi (dengan contoh soal dan penyelesaian)
(Contoh soal dan penyelesaian perlu disertakan di sini dengan ilustrasi yang jelas dan mudah dipahami)
Aplikasi Laju Reaksi dalam Kehidupan Nyata dan Industri
Pemahaman tentang laju reaksi sangat penting di berbagai industri.
Laju Reaksi dalam Industri Makanan
Pengendalian laju reaksi berperan penting dalam pengawetan makanan dan mencegah pembusukan.
Laju Reaksi dalam Industri Farmasi
Laju reaksi menentukan efektivitas dan keamanan obat. Proses pembuatan obat dirancang untuk mengoptimalkan laju reaksi yang diinginkan.
Laju Reaksi dalam Industri Petrokimia
Industri petrokimia bergantung pada pemahaman laju reaksi untuk mengoptimalkan proses produksi bahan bakar dan petrokimia lainnya.
Laju Reaksi dalam Pengolahan Air Limbah
Pengolahan air limbah melibatkan reaksi kimia yang perlu dikendalikan laju reaksinya untuk mencapai efisiensi yang optimal.
Teori Tumbukan dan Hubungannya dengan Laju Reaksi
Teori tumbukan menjelaskan bagaimana laju reaksi dipengaruhi oleh frekuensi dan energi tumbukan antara partikel-partikel reaktan.
Penjelasan Teori Tumbukan
Reaksi kimia hanya terjadi jika partikel-partikel reaktan bertumbukan dengan energi yang cukup (energi aktivasi) dan orientasi yang tepat.
Energi Aktivasi dan Pengaruhnya pada Laju Reaksi
Energi aktivasi adalah energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Semakin rendah energi aktivasi, semakin tinggi laju reaksi.
Hubungan Teori Tumbukan dengan Faktor-Faktor yang Mempengaruhi Laju Reaksi
Teori tumbukan menjelaskan bagaimana faktor-faktor seperti konsentrasi, suhu, dan katalis mempengaruhi laju reaksi dengan mengubah frekuensi dan energi tumbukan.
Mempelajari Lebih Dalam: Konsep Terkait Laju Reaksi
Beberapa konsep terkait laju reaksi perlu dipahami untuk pemahaman yang lebih komprehensif.
Orde Reaksi dan Persamaan Laju Reaksi
Orde reaksi menunjukkan bagaimana laju reaksi dipengaruhi oleh konsentrasi reaktan. Persamaan laju reaksi menyatakan hubungan matematis antara laju reaksi dan konsentrasi reaktan.
Waktu Paruh Reaksi
Waktu paruh reaksi adalah waktu yang dibutuhkan agar konsentrasi reaktan berkurang menjadi setengahnya.
Mekanisme Reaksi (penjelasan singkat dan contoh)
Mekanisme reaksi menjelaskan langkah-langkah detail yang terjadi selama reaksi kimia. (contoh perlu disertakan di sini)
Kesimpulan: Kesimpulan Singkat tentang Pentingnya Memahami Laju Reaksi
Memahami laju reaksi sangat penting dalam berbagai aspek kehidupan, mulai dari memasak hingga industri kimia. Pengendalian laju reaksi memungkinkan kita untuk mengoptimalkan proses kimia dan menghasilkan produk yang diinginkan dengan efisien.
Ayo, bagikan pengalaman dan pertanyaanmu tentang laju reaksi di kolom komentar di bawah! Jangan ragu untuk membaca artikel-artikel lain kami yang berkaitan dengan kimia untuk menambah wawasanmu!